Carlos Valladares de la Cruz
Asesoría Avícola Independiente.
Resumen
Se describe la presentación de un cuadro de intoxicación aguda en pollo de engorda de 18 días de edad caracterizado por depresión severa, postración y muerte repentina así como la metodología para confirmar el diagnóstico. El diagnóstico integral fue Intoxicación aguda medicamentosa. Las pruebas de laboratorio convencionales no fueron suficientes para la confirmación del diagnóstico. Se realizaron algunas pruebas de gabinete para confirmar el efecto de la temperatura del agua sobre la solubilidad de los medicamentos.
PALABRAS CLAVE: Diagnóstico, Intoxicación medicamentosa. Acido acetilsalicílico.
Introducción
Cuando un grupo de aves se enferman sin una causa clara que lo justifique suele emitirse un diagnóstico de “probable intoxicación”. Se sospecha de intoxicación cuando se presenta un cuadro que afecta a un buen número de aves previamente sanas, que se enferman al mismo tiempo y que presentan signos y/o lesiones similares, aunque estos datos también se pueden presentar con enfermedades infecciosas, metabólicas o carenciales. Una sobredosis inadvertida puede causar intoxicación aun con sustancias usualmente consideradas como seguras. Errores de dosificación en la medicación del agua o el alimento frecuentemente conducen a toxicidad; estos errores pueden ser humanos o mecánicos por fallas en los sistemas de dosificación.
Algunos factores medioambientales o de manejo pudieran modificar la exactitud de la dosificación de los medicamentos administrados con fines preventivos o terapéuticos, o bien puede haber interacciones entre las diferentes sustancias que no siempre son consideradas al administrar un tratamiento. Los efectos de una sobredosificación se adicionan a los agentes infecciosos preexistentes, la aplicación de vacunas y a factores medioambientales adversos, conduciendo a cuadros multifactoriales con signos y lesiones de origen tóxico, infeccioso, medioambiental y/o de manejo de difícil diagnóstico.
El análisis toxicológico de los tejidos y otros materiales es costoso y difícil, por lo cual se debe hacer un gran esfuerzo para proporcionar información sobre los elementos que hagan sospechar un diagnóstico de “Probable Intoxicación” y dar sugerencias sobre los tóxicos “sospechosos”. La cantidad de sustancias con efectos tóxicos es muy grande y es prácticamente imposible hacer análisis para todos los posibles agentes tóxicos sin que existan elementos que orienten la investigación. La interpretación de los resultados de laboratorio también es muy complicada ya que no se conocen los niveles de muchas sustancias potencialmente tóxicas considerados como seguros.
Presentación clínica del caso
1.- Caso Indice
HISTORIA CLINICA
Granja de pollo de engorda situada en el noreste de México, de ambiente natural con instalaciones convencionales.
La granja tiene capacidad para alojar 105,000 aves en 6 casetas equipadas con comederos de tolva y bebederos de tipo campana. La granja tiene antecedentes de reacciones postvacunales complicadas.
El presente caso corresponde a una parvada cuyo nacimiento fue en la cuarta semana del mes de diciembre.
La parvada fue recibida con un tratamiento utilizado rutinariamente en la granja, administrado un suplemento de vitaminas y electrolitos, y un antibiótico de amplio espectro.
La granja presentó una mortalidad acumulada del 0.5% durante la primera semana de vida.
El calendario de vacunación utilizado se observa en el Cuadro 1, incluyó la aplicación de una vacuna polivalente de virus vivos con los virus de Enfermedad de Newcastle cepa La Sota y de Bronquitis Infecciosa cepas Massachusetts y Connecticut, la cual se aplicó a los 10 días de edad, por vía ocular utilizando una dosis por ave.
Cuatro días después de la aplicación de la vacuna ocular se presentó una reacción post vacunal de moderada a fuerte con un cuadro febril, depresión y erizamiento de plumas. La reacción postvacunal fue tratada con un medicamento antipirético en el agua de bebida, a la dosis indicada por el fabricante, durante 5 días, a partir del día 14 de edad. No se administró ningún otro medicamento para la reacción postvacunal.
Además de los signos atribuibles a la reacción postvacunal, no se observaron otros signos que indicaran algún proceso de enfermedad adicional. La respuesta a la terapia para controlar la reacción postvacunal fue moderada y a partir del día 16 de edad se observó un incremento súbito en la mortalidad en algunas casetas, aunque de proporción variable entre las mismas, el incremento de la mortalidad duró entre 3 y 5 días, y posteriormente disminuyó a los niveles esperados para la granja. La mortalidad durante el período del día 16 al día 20 alcanzó un promedio del 3%. Algunos de los cadáveres mostraban restos de líquido sanguinolento en la mucosa cloacal.
 LESIONES
LESIONES
Se procedió a la realización de la necropsia en las aves muertas en la granja.
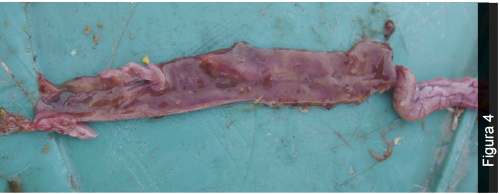
Las lesiones observadas de manera constante en las aves encontradas muertas en las casetas durante el período de incremento de la mortalidad fueron contenido de la molleja y del intestino delgado con presencia de sangre fresca o parcialmente digerida en la luz, en cantidad abundante (Figura 1 y Figura 2), ulceración severa de la mucosa de la molleja (Figura 3) y hemorragias difusas severas en la mucosa de duodeno y yeyuno (Figura 4).
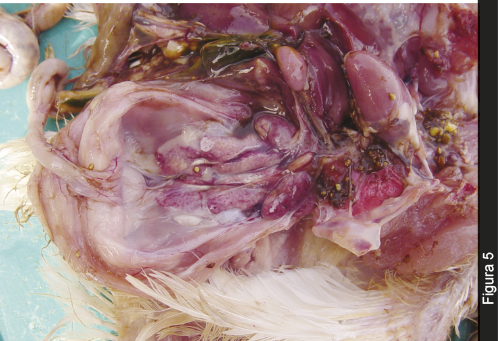
Aproximadamente un 30% de estas aves presentaron adicionalmente nefromegalia y palidez marcada de los riñones, con presencia de cristales de uratos en la luz de los uréteres (Figura 5) y aproximadamente un 10% de estas aves presentó uratosis severa en las serosas de la cavidad abdominal. No se observaron lesiones en los demás tejidos de las aves muertas de manera espontánea.
CUADRO 1: Calendario de vacunación utilizado en la parvada afectada:
Se seleccionaron algunas aves de la parvada con signos inespecíficos de depresión moderada y erizamiento de plumas. Sin embargo, ninguna de las aves seleccionadas presentó lesiones similares a las observadas en las aves muertas de manera espontánea. En las aves seleccionadas sólo se observó traqueítis mucosa moderada.
 MUESTREO
MUESTREO
Se seleccionaron 10 aves vivas con depresión moderada y 10 aves muertas de manera espontánea para su análisis de laboratorio.
PRUEBAS Y RESULTADOS DE LABORATORIO
1. Aves vivas:
INSPECCION CLINICA: Se observó depresión leve, erizamiento de plumas y estertores traqueales leves en las 10 aves recibidas para su análisis.
NECROPSIA: Las lesiones más importantes fueron traqueítis mucosa moderada en las 10 aves analizadas.
ESTUDIO SEROLOGICO: Se realizó el estudio serológico a partir de los 10 sueros procedentes de las aves vivas remitidas para su estudio.
Los 10 sueros resultaron negativos a la presencia de anticuerpos en las pruebas de Aglutinación en Placa para M. gallisepticum y para M. synoviae. Estos sueros fueron negativos a la prueba de Inhibición de la hemaglutinación para Influenza Aviar y fueron positivos a la presencia de anticuerpos contra el virus de la Enfermedad de Newcastle con los siguientes títulos: 1:4 1/10, 1:8 1/10, 1:16 4/10, 1:32 1/10, 1:64 1/10, 1:128 1/10, 1:256 1/10, con una media geométrica de 1:25.98.
En las pruebas de ELISA, no se detectaron anticuerpos contra los virus de Bronquitis Infecciosa ni de Infección de la bolsa de Fabricio.
 ESTUDIO BACTERIOLÓGICO: Se realizó el aislamiento de bacterias aerobias en Agar Sangre, Agar McConkey y, Agar de Sal y Manitol, por siembra directa a partir de hisopos de órganos, así como a partir de muestras de tejido de hígado, bazo, vesícula biliar y tonsilas cecales para aislamiento de Salmonella. El estudio bacteriológico fue negativo al aislamiento de Salmonella spp. Se aisló Escherichia coli en cantidad escasa a partir de la tráquea y no se obtuvo ningún aisla- miento bacteriano a partir de pulmón, hígado y bazo.
ESTUDIO BACTERIOLÓGICO: Se realizó el aislamiento de bacterias aerobias en Agar Sangre, Agar McConkey y, Agar de Sal y Manitol, por siembra directa a partir de hisopos de órganos, así como a partir de muestras de tejido de hígado, bazo, vesícula biliar y tonsilas cecales para aislamiento de Salmonella. El estudio bacteriológico fue negativo al aislamiento de Salmonella spp. Se aisló Escherichia coli en cantidad escasa a partir de la tráquea y no se obtuvo ningún aisla- miento bacteriano a partir de pulmón, hígado y bazo.
ESTUDIO VIROLOGICO: Se realizó la prueba de aislamiento viral en embrión de pollo comercial a partir de macerado de tráquea, pulmón, bazo y tonsilas cecales, vía cavidad alantoidea, para el aislamiento de los virus de Influenza Aviar, Enfermedad de Newcastle y Bronquitis Infecciosa, realizando 4 pases consecutivos. Se aisló una cepa lentogénica del virus de Enfermedad de Newcastle al primer pase. No se aisló ningún virus de Influenza Aviar ni de Bronquitis Infecciosa después de 4 pases ciegos consecutivos.
 ESTUDIO HISTOPATOLÓGICO: No se observaron lesiones microscópicas en la bolsa de Fabricio, timo ni riñón en ninguna de las aves analizadas, se observó congestión moderada en uno de los bazos y necrosis fibrinoide multifocal leve en otro de los bazos, en el hígado se observó congestión leve en 6 aves y pericolangitis no supurativa leve en 4 aves.
ESTUDIO HISTOPATOLÓGICO: No se observaron lesiones microscópicas en la bolsa de Fabricio, timo ni riñón en ninguna de las aves analizadas, se observó congestión moderada en uno de los bazos y necrosis fibrinoide multifocal leve en otro de los bazos, en el hígado se observó congestión leve en 6 aves y pericolangitis no supurativa leve en 4 aves.
ESTUDIO PARASITOLOGICO: Con la técnica de McMaster no se observaron coccidias a partir de muestras del contenido cecal de las aves analizadas.
ESTUDIO TOXICOLOGICO DEL ALIMENTO: Se colectaron 4 muestras de alimento de las casetas más afectadas, directamente de los comederos, para la detección de las siguientes micotoxinas: Aflatoxinas Totales (fluorometría), Ochratoxina A (fluorometría) y Toxina T-2 (ELISA), encontrando los siguien- tes niveles: Aflatoxinas totales (ppb): 10, 6, 13, 7; Ochratoxina A(ppb):14,24,<2y5,yToxinaT-2(ppb),41,<25,<25y34.
INTERPRETACION DE RESULTADOS DE LAS PRUEBAS REALIZADAS EN LAS AVES VIVAS:
Los resultados de los estudios realizados en las aves vivas sacrificadas para su análisis fueron esencialmente normales. La cepa lentogénica del virus de la Enfermedad de Newcastle aislada fue interpretada como cepa de origen vacunal y la presencia de Escherichia coli en cantidad escasa en la tráquea fue interpretada como una complicación bacteriana leve de la reacción postvacunal.
La concentración de Aflatoxinas, Ochratoxina A y Toxina T-2 en el alimento se encontraron por debajo de los límites máximos permisibles, de acuerdo a los parámetros de la empresa.
 2. Aves muertas de forma espontánea:
2. Aves muertas de forma espontánea:
NECROPSIA: Las lesiones observadas en las aves muertas en la granja de manera espontánea fueron similares a las observadas en las necropsias de campo. Todas las aves presentaron contenido gastrointestinal de color rojo oscuro y aspecto sanguinolento, ulceración de la molleja y hemorragias en la mucosa del intestino delgado. La mitad de las aves analizadas presentaron además nefromegalia con presencia de uratos en los uréteres.
OBSERVACION MICROSCOPICA DEL CONTENIDO GASTROINTESTINAL: El contenido de la molleja fue observado con un microscopio estereoscópico y a partir del contenido del intestino delgado anterior se realizaron frotis para su observación con el microscopio óptico. La observación estereoscópica del contenido de la molleja reveló partículas de alimento, porciones de granos de sorgo, partículas de pasta de soya y restos de sangre coagulada. No se observaron partículas metálicas o de vidrio en el mismo. El frotis del contenido del intestino delgado mostró abundante cantidad de eritrocitos.
DETECCION DE SANGRE EN EL CONTENIDO INTESTINAL: Se realizó una prueba para la detección de sangre oculta en heces a partir del contenido del intestino delgado, con tiras reactivas comerciales, resultando fuertemente positiva a la presencia de Hemoglobina.
ESTUDIO HISTOPATOLÓGICO: El estudio histológico de la molleja reveló la presencia de lisis de la capa de queratina y la presencia de úlceas en la mucosa, con bordes abiertos y superficie sangrante (Figura 7). El intestino delgado anterior presentó congestión y hemorragias difusas severas en la mucosa, con desprendimiento del epitelio intestinal. El riñón presentó degeneración tubular difusa severa, congestión multifocal severa y depósitos multifocales de cristales basófilos (similares a cristales de uratos) en el parénquima.
No se observaron lesiones microscópicas en la bolsa de Fabricio, timo, bazo, hígado, páncreas, tráquea, pulmón ni encéfalo en ninguna de las aves analizadas.
INTERPRETACION DE RESULTADOS DE LAS PRUEBAS REALIZADAS EN LAS AVES MUERTAS DE FORMA ESPONTANEA: Los resultados de los estudios realizados en las aves muertas se interpretaron como ulceración y hemorragias gastrointestinales severas, y degeneración renal con uratosis de etiología no determinada.
SE EMITIO UN DIAGNOSTICO PRESUNTIVO DE PROBABLE INTOXICACION DE ETIOLOGIA NO DETERMINADA. Las lesiones observadas en las aves muestras de manera espontánea sugirieron un cuadro de Vómito Negro por ingestión de alimento elaborado con harina de pescado en estado de putrefacción, intoxicación por micotoxinas con actividad cáustica para la mucosa digestiva, como Toxina T-2 o micotoxinas similares, o bien, la ingestión accidental de alguna sustancia fuertemente cáustica. Eventualmente un cuadro hemorrágico pudo haber sido causado por deficiencia de vitamina K, intoxicación por Sulfas o intoxicación por gosipol.
No se encontraron evidencias de ningún proceso infeccioso relacionado al caso. Los niveles de mortalidad regresaron a los niveles esperados en un período de 5 días.
2.- CASOS SUBSECUENTES
Después del Caso Indice, se volvió a presentar el mismo caso en otras tres granjas que fueron replobladas dentro de los 8 siguientes días a la repoblación de la Granja del Caso Indice. En las 4 granjas la presentación del caso fue similar. En las cuatro granjas las instalaciones, el equipo, el sistema de crianza, el manejo de la recepción, el calendario de vacunación, el alimento y el tratamiento de la reacción postvacunal fueron similares. En todos los casos el incremento de la mortalidad duró entre 3 y 5 días. En las dos últimas granjas afectadas se decidió suspender el tratamiento de la reacción postvacunal antes de su terminación.
CUADRO 1: Calendario de vacunación utilizado en la parvada afectada:
|
Edad |
Vacuna |
Cepa |
Dosis y vía aplicación. |
|
1 día |
Marek + |
HVT+SB1 |
1 Dosis/ave Subcutánea |
|
Infección de la bolsa de Fabricio |
ST 14 |
1 Dosis. Subcutánea |
|
|
6 días |
Infección de la B. de Fabricio |
Lukert intermedia |
1 Dosis/ave. Agua bebida |
|
10 días |
Enf. de Newcastle+Bronquitis Infecciosa |
La Sota, Massachusetts Connecticut |
1 Dosis/ave. Ocular |
|
Enf. de Newcastle+Bronquitis Infecciosa+Hepatitis con Cuerpos de Inclusión. |
La Sota |
0.5ml/Ave. Subcutánea |
|
|
16 días |
Infección de la B. de Fabricio |
ST 12 |
1 Dosis/ave. Agua bebida |
ANALISIS RETROSPECTIVO Y ANALISIS ADICIONALES EPIDEMIOLOGIA DE LA REGION:
Todos los casos se presentaron en una misma zona y en un período de dos semanas en la primera y segunda semana del mes de enero.
La temperatura ambiental promedio durante las tres primeras semanas de vida de las parvadas osciló entre los 2°C y los 10°C, con lluvia ocasional y nublado constante. El control de la temperatura en el interior de las casetas se realizó por medio de criadoras convencionales de gas licuado.
El alimento administrado fue de tipo iniciador, adicionado con un Nicarbacina – Narasina como coccidiostato. La densidad calculada de nutrientes de acuerdo a la formulación fue de 22% de proteína cruda, 4% de grasa, 6% de ceniza y 11% de humedad (Cuadro 2). El alimento fue elaborado a base de sorgo y pasta de soya como ingredientes principales, y en su formulación no se incluyó ninguna fuente de proteína de origen animal.
CUADRO 2: Densidad calculada de los nutrientes del alimento iniciador de las granjas afectadas.
|
Humedad |
Proteína Cruda. |
Grasa |
Ceniza |
Fibra Cruda |
Calcio |
Sal |
Fósforo |
|
11 % |
22 % |
4% |
6% |
2.8 % |
0.9 % |
0.2% |
0.75 |
La parvada fue recibida con un suplemento de vitaminas y electrolitos en el agua de bebida, a una dosis de 125 g en 400 litros de agua, durante 3 días, de acuerdo a las instrucciones del fabricante. El contenido del suplemento de vitaminas y minerales se observa en el Cuadro 3. También se recibió con el antibiótico enrofloxacina en el agua de bebida, a una dosis de 10 mg por kilogramo de peso, durante los tres primeros días de edad, de acuerdo a las indicaciones del fabricante.
No se administró ningún otro medicamento hasta el día 14 para controlar la reacción postvacunal.
A partir de los 14 días de edad la parvada recibió un tratamiento sintomático con ácido acetilsalicílico en una presentación comercial con 40 g de acido acetilsalicílico en 100 ml de vehículo. El producto se dosificó a razón de 1 ml por litro de agua y se administró durante 5 días, de acuerdo a las indicaciones del fabricante. No se administró ningún otro tipo de medicamento para la reacción postvacunal.
CUADRO 3.- Fórmula del suplemento de vitaminas y minerales utilizado en la recepción del pollo.
|
Contenido por cada 100 g |
|
|
Vitamina A |
600,000 UI. |
|
Vitamina D 3 |
200,000 UI. |
|
Vitamina E |
100 UI. |
|
Vitamina B 12 |
0.002 g. |
|
Vitamina K |
0.275 g. |
|
Riboflavina |
0.320 g. |
|
Niacina |
1.200 g. |
|
Pantotenato de Calcio |
0.500 g. |
|
Cloruro de Sodio |
1.000 g. |
|
Acetato de Sodio |
1.000 g. |
|
Gluconato de Calcio |
4.000 g. |
|
Excipiente c.b.p. |
100 g. |
ANALISIS PARA ENCONTRAR LA POSIBLE FUENTE DE LA INTOXICACION
Análisis del alimento: se realizaron estudios bromatológicos, toxicológicos y microbiológicos de 3 muestras adicionales de alimento colectadas directamente de los comederos de tres de las granjas afectadas. Los resultados se observan en el Cuadro 4.
En el análisis químico proximal de las muestras de alimento, una de las muestras presentó un contenido de proteína menor al esperado. El nivel de fósforo fue ligeramente menor al esperado en las tres muestras. El resto de los macronutrientes se encontraron dentro de los parámetros esperados de composición del alimento de acuerdo a su formulación. De acuerdo a los resultados de estos análisis, no se encontraron evidencias de deficiencias de ningún macronutriente en los alimentos de las parvadas afectadas.
CUADRO 4.- Análisis bromatológico, toxicológico y microbiológico de 3 muestras de alimento de 3 granjas afectadas.
|
Análisis |
Granja 1 |
Granja 2 |
Granja 3 |
Valor de referencia* |
|
Bromatológico |
||||
|
Humedad |
11.6 |
11.6 |
12.0 |
11 % |
|
Proteína Cruda |
22.0 |
22.2 |
17.7 |
22 % |
|
Grasa Cruda |
4.2 |
4.3 |
3.0 |
4% |
|
Cenizas |
6.5 |
6.6 |
6.7 |
6% |
|
Fibra Cruda |
2.3 |
3.7 |
2.6 |
2.8 % |
|
Calcio |
1.19 |
1.19 |
1.60 |
0.9 % |
|
Sal |
0.29 |
0.34 |
0.28 |
0.2 % |
|
Fósforo |
0.62 |
0.62 |
0.58 |
0.75 % |
|
Toxicológico |
||||
|
Aflat. Total |
2 |
24 |
2 |
< 20 ppb |
|
Ochratoxina A |
4 |
4 |
5 |
< 20 ppb |
|
Zearalenona |
< 100 | < 100 | 115 | < 150 ppb |
|
Toxina T-2 |
< 25 | < 25 | < 25 | < 100 ppb |
|
Vomitoxina |
329 | < 200 | 404 | < 500 ppb |
|
Diascetoxicispernol |
< 20 | < 20 | < 20 | n.d. |
|
Microbiológico |
||||
|
Salmonella spp |
no detectable |
no detectable |
no detectable |
no detectable |
|
Escherichia coli |
no detectable |
no detectable |
no detectable |
no detectable |
|
Mesófilos aerobios |
1,400 |
2,300 |
14,000 |
< 1000 ufc |
|
Estafilococcus |
300 |
1,000 |
400 |
|
|
Coliformes totales |
1,000 |
< 10 | < 10 | < 10 ufc |
|
Hongos |
400 |
< 10 | < 10 | < 10 ufc |
|
Levaduras |
< 10 |
< 10 | < 10 | < 10 ufc |
n.d.: no determinado
El análisis toxicológico no reveló niveles superiores a los máximos permitidos para aflatoxinas totales, ochratoxina A, zearalenona, toxina T-2, vomitoxina ni diascetoxicispernol en ninguna de las muestras. El estudio bacteriológico mostró niveles bajos de bacterias mesófilas tota- les y estafilococcos, sin llegar a ser considerados como una contaminación masiva. La presencia de bacterias en el alimento fue considerada como esperada ya que las muestras fueron colectadas directamente de los comederos en el interior de las casetas.
En la planta de fabricación del alimento no se utiliza harina de pescado como fuente de proteína en ningún alimento, por lo que el cuadro de Vómito Negro fue descartado. Sin embargo, debido a que en la planta de alimentos utilizaban como ingredientes harina de carne-hueso y harina de ave en la formulación de alimentos finalizadores de pollo de engorda, se analizaron las concentraciones de aminas biogénicas en las muestras de 4 lotes de harina de ave y 2 lotes de harina de carne-hueso recibidas en los meses de noviembre y diciembre, encontrándose en promedio 49.66 ppm de putresina, 52.42 ppm de cadaverina, 22.17 ppm de histamina y 17.34 ppm de tiramina. Aunque no se conocen los niveles de aminas biogénicas considerados como seguros en las harinas de ave o de carne-hueso. En las harinas de pescado el único valor que se evalúa de manera constante es la concentración de histamina, y los niveles considerados como seguros son inferiores a 500 ó 1000 ppm. Los niveles encontrados en los ingredientes de origen animal recibidos durante los dos meses previos a la aparición de la enfermedad, fueron menores al promedio histórico de los ingredientes. Los niveles de histamina promedio de las seis muestras fueron de 22.17 ppm, el cual es mucho más bajo que los niveles considerados como seguros (500-1000 ppm) en la harina de pescado.
Con estos datos se consideró que, aun si las harinas de origen animal hubieran sido erróneamente incluidas en la ración, los niveles de aminas biogénicas en el alimento, especialmente de histamina, serían muy bajos para provocar ulceración de la molleja, por lo que la presencia de aminas biogénicas en el alimento fue descartada como la causa del problema. En la planta de fabricación de alimentos no se utiliza harina de algodón como ingrediente para ningún alimento, por lo que la intoxicación con gosipol fue descartada.
Los análisis del alimento no proporcionaron indicios de la probable fuente de una intoxicación.
2.- Análisis de los tratamientos aplicados a las parvadas.
No se aplicó ningún tratamiento a base de sulfas en ninguna parvada, tampoco se adicionaros compuestos con sulfas en el alimento, por lo que la intoxicación con sulfas fue descartada del diagnóstico diferencial.
Los tratamientos aplicados a las parvadas afectadas fueron: un suplemento de vitaminas y electrolitos en el agua de bebida durante los primeros tres días de vida. Enrofloracina al 10% en solución oral durante los primeros tres días de vida y acido acetilsalicílico al 40% a una dosis de 1 ml por litro de agua, durante 3 a 5 días a partir del día 14 de edad, durante 12 horas continuas por día.
El estudio retrospectivo de los casos detectó que uno de los factores que pudiera estar relacionado a la presentación de los casos fue el tratamiento de la reacción postvacunal con acido acetilsalicílico.
El único tratamiento que fue aplicado en los días previos a la presentación del cuadro clínico fue el tratamiento con ácido acetilsalicílico; la mortalidad disminuyó en dos de las granjas afectadas después de que terminó el tratamiento y en las otras dos granjas el tratamiento fue suspendido antes de lo previsto, disminuyendo la mortalidad al segundo día de suspender el tratamiento.
El tratamiento con acido acetilsalicílico fue aplicado, según lo describió el personal responsable de administrar el tratamiento, de acuerdo a las instrucciones del fabricante, a una dosis de 1 ml por 100 ml de agua y fue administrado por 12 horas continuas, por día, durante 5 días. Se preparó una “solución madre” del producto que luego fue aforada en los tinacos de agua de las casetas. Se afectó un total de 4 granjas casi de forma simultánea y el personal encargado de la aplicación del medicamento fue particular para cada una de las granjas. Estos datos sugirieron que era poco probable que en cuatro granjas diferentes se cometiera un error de dosificación de manera simultánea por personal diferente. Se analizó la cantidad de producto utilizado en cada caso y no se encontraron indicios de un uso excesivo del medicamento, de acuerdo al consumo de agua de las parvadas tratadas.
Para analizar las características del producto, se constató en la ficha técnica que la concentración del ácido acetilsalicílico del producto comercial. En la ficha técnica del producto utilizado no se describe el excipiente en el que está diluido el principio activo. De acuerdo a la etiqueta, el producto contenía 40 g del principio activo en 100 ml de diluyente. Todo el medicamento utilizado en las cuatro granjas procedió del mismo lote. El certificado de análisis de dicho lote indicó que el producto es una solución amarilla ligeramente viscosa con una concentración de 42.349 g de ácido acetilsalicílico/100 ml, lo cual cumplió con las especificaciones del proveedor. Para constatar lo anterior se enviaron muestras de dos frascos del medicamento, utilizados en las granjas afectadas, para la determinación química del ácido acetilsalicílico, por espectrofotometría con el Método FEUM 8a Ed, pp 1369. Los resultados de dicho ensayo fueron 39.12 g/100 ml y 39.41 g/100 ml, con una concentración promedio del 98.2% de la garantizada por el fabricante.
Aparentemente el producto cumplió con las especificaciones de la etiqueta y fue administrado de acuerdo a las indicaciones del fabricante.
El personal encargado de preparar y administrar el medicamento no reportó ningún problema con la solubilidad del medicamento y el certificado de análisis describió la solubilidad como “completa a la dilución indicada”.
La literatura científica del ácido acetilsalicílico lo describe como un polvo cristalino blanco o incoloro, fácilmente soluble en alcohol, soluble en éter y poco soluble en agua. La solubilidad en agua a 25°C es de 3.3 g/litro. En humanos, se han descrito como efectos secundarios más frecuentes, aun con dosis terapéuticas, trastornos gastrointestinales con nauseas, dispepsia y vómito; puede producirse irritación de la mucosa gástrica con erosión y ulceración, ulceración duodenal, hematemesis y melena, con aumento del tiempo de sangrado, disminución de la agregación plaquetaria e hipoprotombinemia.
El consumo excesivo de ácido acetilsalicílico causa nefritis y degeneración renal. En Medicina Veterinaria la intoxicación ha sido descrita en perros y gatos, siendo los gatos más susceptibles. Las lesiones observadas consisten en úlceras gástricas y duodenales. La dosis tóxica en perros es de 50 mg/kg/día y en gatos de 25 mg/kg/día. La dosis terapéutica en perros es de 10 mg/kg cada 12 horas y en gatos es de 6 mg/kg cada 48-72 horas. No se encontró en la literatura consultada ninguna descripción del efecto tóxico del ácido acetilsalicílico en pollos o gallinas, aunque las lesiones obser- vadas en este caso eran similares a las descritas con la intoxicación por ácido acetilsalicílico en otras especies.
En un intento para comprobar la causa de la intoxicación se decidió tratar de replicar el cuadro bajo condiciones de bioterio, utilizando la dosis terapéutica administrada y dosis mayores. De manera circunstancial se detectó que la solubilidad del producto presentó grandes variaciones dependiendo de la temperatura del agua para diluirlo. Con la dosis recomendada el producto presentó una dilución adecuada a 30°C, 25°C y 20°C. Sin embargo, con temperaturas del agua de 15°C, 10°C y 5°C el producto presentó una dilución incompleta en el agua, permaneciendo restos del medicamento sin diluirse completamente en el agua, lo que fue detectado visualmente como pequeñas “nubes” de color blanquecino en el agua usada para la dilución (Figura 8). Se observó además que la falta de dilución del producto a bajas temperaturas fue permanente y el producto no pudo ser diluido incrementando posteriormente la temperatura del agua de la dilución.
Para la replicación de las lesiones se utilizaron 10 pollos de 20 días, a los cuales se les administró el ácido actilsalicicílico preparado a la dosis terapéutica de 1 ml/100 ml de agua, y se administró de manera continua durante 7 días, utilizando esta preparación como fuente única de agua. La dilución del medicamento se realizó en agua corriente a 10°C y el producto presentó dispersión incompleta en el agua. Cuatro de las aves utilizadas murieron entre 3 y 5 días después de iniciado el tratamiento. Las aves muertas presentaron proventriculitis ulcerativa severa con hemorragias abundantes en proventrículo y en duodeno. 6 aves sobrevivieron los 7 días de tratamiento, 4 aves no presentaron lesiones macroscópicas y 2 aves presentaron erosiones moderadas en la mucosa de la molleja.
Conclusiones
Se emitió un diagnóstico final de Intoxicación Medicamentosa por ácido acetilsalicílico.
La concentración del ácido acetilsalicílico en el medicamento utilizado en el producto comercial fue adecuada, así como la preparación de la dosis para administrar a las aves. Sin embargo, aparentemente el producto utilizado presentó falta de solubilidad con temperaturas del agua de preparación frías, por lo menos de 15°C o menores. Cabe recordar que los casos se presentaron en la primera y segunda semana del mes de enero, con una temperatura ambiental entre 2 y 10°C, lluvia ocasional y nublado constante. Es muy probable que el agua utilizada para la preparación del tratamiento haya estado excesivamente fría, lo que interfirió con la solubilidad completa del medicamento. Debido a esta falla en la solubilidad, es posible que algunas aves hayan ingerido agua con una dosis excesiva de ácido acetilsalicílico y se hayan intoxicado, presentando lesiones similares a las descritas en humanos y, en perros y gatos. El incremento en la mortalidad observado se presentó después de 1 ó 2 días de que las aves recibieron el tratamiento y también cesó 1 ó 2 días después de que el tratamiento fue retirado.
Control y Prevención del Caso
Es importante conocer las características físicas de los medicamentos utilizados en las granjas y es recomendable que el fabricante de los productos sea lo más preciso posible al indicar cuál es la forma de preparación de los productos y si existen algunos factores que puedan afectar su solubilidad.
Es también importante que el personal encargado de preparar los medicamentos a administrar verifique que las dosis administradas de los medicamentos sean las adecuadas, de acuerdo a las instrucciones del fabricante. También es importante verificar que las soluciones de medicamentos preparadas estén homogéneamente distribuidas y se debe reportar alguna anormalidad detectada durante su preparación.
Usualmente la actividad tóxica de una sustancia depende de la dosis. Una sobredosis inadvertida puede causar intoxicación aun con sustancias usualmente consideradas como seguras. Errores de dosificación en la medicación del agua o el alimento frecuentemente conducen a toxicidad; estos errores pueden ser humanos o mecánicos por fallas en los sistemas de dosificación. Algunos factores medioambientales o de manejo pudieran modificar la exactitud de la dosificación de los medicamentos administrados con fines preventivos o terapéuticos, o bien puede haber interacciones entre las diferentes sustancias que no siempre son consideradas al administrar un tratamiento.
Referencias
1. Acetylsalicylic acid». Jinno Laboratory, School of Materials Science, Toyohashi University of Technology (March 1 1996).
2. Acido Acetilsalicílico. Medciclopedia. Word Press Themes, 2005.
3. Acido Acetilsalicílico. D-Salud. Ediciones MK3, España, 2006.
4. Avian Histopathology, American Association of Avian Pathologist, University of Pennsylvania, USA, Edited by O. Fletcher, 2008.
5. A Laboratory Manual for the Isolation and Identification of Avian Pathogens, Fourth Edition, Published by The American Association of Avian Pathologist, University of Pennsylvania, USA, 1998.
6. Bermudez, A. and Stewart-Brown B.: Disease Prevention and Diagnosis, in Chapter 1, Principles of disease prevention: diagnosis and control. Diseases of Poultry, eleventh edition 2003, editor in Chief Y.M. Saif, Iowa State Press.
7. Brown, T. and Julian, R.; Chapter 33 Other toxins and poisons. Diseases of Poultry, eleventh edition 2003, editor in Chief Y.M. Saif, Iowa State Press.
8. Ferguson, RK; Boutros, AR. «Death following self-poisoning with aspirin». Journal of the American Medical Association.
9. Luengo, M y Gutierrez-Aragon, J.: Tratamiento de urgencia en intoxicaciones en perros y gatos. Acido acetilsalicílico. Ciencias Veterinarias, España, 2005.
10. Kaufman, FL; Dubansky. «Darvon poisoning with delayed salicylism: a case report». Pediatrics 49 (4): 610.
11. Manual de Procedimientos de Laboratorio. Laboratorio de Control de Calidad y Patología Aviar, PAPSA, editado por MVZ. J.C. Valladares, 2007.
12. Medina, J.C.: Evaluación de fuentes de proteína de origen animal como ingredientes de alimentos balanceados para aves, en Segundo curso de actualización Avimex de Toxicología Aviar, México, D.F., 1990.
13. Prontuario de Especialidades Veterinarias Thompson. PLM Edición 23, México. 2003-2004.
14. Valladares, J.C.: Elementos requeridos para un diagnóstico de laboratorio, en Integración del Diagnóstico en la Industria Avícola y Patología comparada entre las aves de corral convencionales (incluyendo pollos, pavos, patos, gansos, codornices) y las aves de ornato, deporte, mascotas y silvestres en Cautiverio. Asociación Nacional de Especialistas en Ciencias Avícolas de México A.C. ANECA, Puebla, Puebla, 2-3 de diciembre de 2009.
Artículo Publicado en Los Avicultores y su Entorno 75










